Compania Pfizer a cerut autorizarea de urgenţă în SUA a pastilei sale anti-COVID-19, un tratament foarte aşteptat pentru că poate fi administrat cu uşurinţă acasă în primele zile după apariţia simptomelor, în caz de contaminare.
Pfizer a depus cererea pentru autorizarea acestui tratament antiviral la Agenţia pentru Medicamente a Statelor Unite (FDA), a anunţat gigantul farmaceutic într-un comunicat.
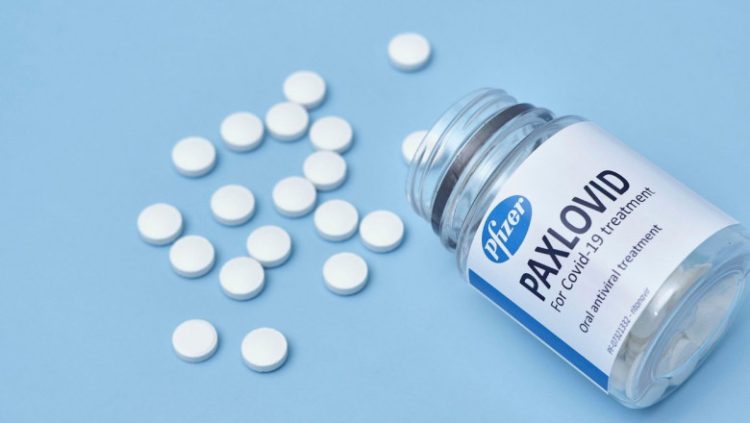
PAXLOVID, PASTILA ANTI-COVID-19 DE AL PFIZER
La începutul lunii noiembrie, Pfizer, care comercializează deja împreună cu compania germană BioNTech unul dintre cele mai eficiente vaccinuri împotriva COVID-19, a dezvăluit că antiviralul său oral va fi comercializat sub numele de Paxlovid, scrie Agerpres. Pastila a demonstrat o eficienţă de 89% în prevenirea riscului de spitalizare sau de deces dacă este administrată în primele trei zile de la apariţia simptomelor, conform rezultatelor intermediare ale studiilor clinice.
Testele au fost întreprinse de Pfizer pe persoane adulte cu risc crescut de a dezvolta o formă severă a bolii COVID-19. Acestea au ingerat medicamentul o dată la fiecare 12 ore, timp de cinci zile.
Citește și: Un nou vaccin anti-Covid dovedește rezultate remarcabile. Covaxin a fost deja aprobat de OMS și poate fi extrem de util în țările sărace
Washington Post a informat că executivul american intenţionează să anunţe săptămâna aceasta achiziţionarea a 10 milioane de tratamente antivirale. Pfizer a anunţat că va investi până la 1 miliard de dolari în fabricarea şi distribuirea de Paxlovid.
Şi laboratorul american Merck a dezvoltat un tratament antiviral, Molnupiravir, autorizat la începutul lui noiembrie într-o primă ţară, Regatul Unit.
Un comitet al FDA urmează să se reunească pe 30 noiembrie pentru a se pronunţa asupra cererii de autorizare a tratamentului Merck în SUA. Washingtonul a achiziţionat deja 3,1 milioane de tratamente Merck.











 – Servicii de creare site web
– Servicii de creare site web
